私たちが普段、当たり前のように手に取る薬。
しかし、その一錠が患者さんの元に届くまでには、平均して10年以上という長い年月と、数百億円から数千億円にも上る莫大な費用、そして「成功確率2万分の1」とも言われるほどの険しい道のりが存在します。
一つの新薬が世に出る確率は、様々なデータがありますが、約2万〜3万分の1とも言われています。
これは、研究開発の各段階で、有効性や安全性の観点から数多くの候補物質がふるいにかけられていくためです。
本記事では、製薬会社の研究開発部門で10年以上新薬開発に携わってきた私が、薬のタネを見つける「基礎研究」から、国に承認されるまでの全5段階のプロセスを、研究現場のリアルな視点を交えながら、図解でわかりやすく解説します。
この記事を読めば、新薬がいかに多くの人々の情熱と努力の結晶であるかが分かります。
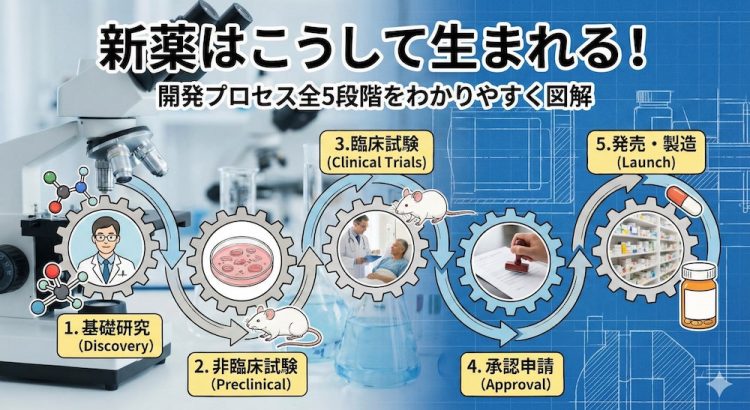
【図解】新薬開発の全貌!研究から承認まで5つのステップ
新薬開発は、大きく分けて5つのステップで進められます。
それぞれのステップには長い期間と厳しい関門が待ち受けており、数万個あった「薬の候補」は、最終的にたった一つの「新薬」へと絞り込まれていきます。
まずは、その壮大な旅の全体像を掴んでみましょう。
- ステップ1:基礎研究(2~3年)- 薬のタネを探す
- ステップ2:非臨床試験(3~5年)- 動物・細胞で安全性を確かめる
- ステップ3:臨床試験(治験)(3~7年)- ヒトで有効性と安全性を確かめる
- ステップ4:承認申請・審査(1~2年)- 国の承認を得る
- ステップ5:製造販売・市販後調査 – 発売後も薬を育てる
ステップ1:基礎研究(期間:2~3年)- 薬のタネを探す冒険
すべての新薬開発は、この「基礎研究」から始まります。
まだ誰も知らない、病気を治す可能性を秘めた「薬のタネ」を探し出す、まさに冒険のようなステージです。
何を・なぜ研究する? 標的分子の探索
まず研究者たちは、「なぜその病気が起こるのか?」という根本的な問いからスタートします。
近年のゲノム研究の進展により、多くの病気が特定の遺伝子やタンパク質の異常によって引き起こされることが分かってきました。
この病気の原因となる遺伝子やタンパク質を「創薬標的分子(ターゲット)」と呼びます。
研究者たちは、膨大な医学・生物学の論文を読み解き、最新の研究成果を駆使して、どの標的分子にアプローチすれば病気を治療できるか、仮説を立てて検証を繰り返します。
この最初の標的選びが、10年以上にわたる新薬開発の成否を大きく左右する、極めて重要なプロセスなのです。
数千万の化合物から「金の卵」を探す
治療の標的が決まったら、次はその標的に作用して、狙い通りの効果を発揮する物質を探し出します。
製薬会社は、「化合物ライブラリー」と呼ばれる、数百万から数千万種類にも及ぶ多種多様な化合物のコレクションを保有しています。
この膨大なライブラリーの中から、「金の卵」となる候補物質を見つけ出す方法は、主に以下の通りです。
- 化学合成: 既知の化合物の構造をヒントに、化学者が新たな化合物を設計し、合成します。
- 天然物からの探索: 植物や微生物、海洋生物などが作り出す天然の物質から、有用なものを探し出します。
- バイオテクノロジー: 抗体医薬など、遺伝子工学の技術を用いて作り出される医薬品の候補を探します。
ライターの視点
私が担当したプロジェクトでは、沖縄の海洋微生物が持つ特殊な物質から、がん細胞の増殖を抑えるヒントを得ました。
このように自然界にはまだ見ぬ宝が眠っています。
論文の片隅に書かれた記述や、学会での何気ない会話から、世紀の発見に繋がるアイデアが生まれることも少なくありません。
日々の地道な実験と、研究者のひらめきが交差する、非常にクリエイティブな段階です。
ハイスループットスクリーニングとは?
数千万もの化合物の効果を一つひとつ手作業で調べていては、時間がいくらあっても足りません。
そこで活躍するのが、「ハイスループットスクリーニング(HTS)」という技術です。
これは、ロボット技術やAI(人工知能)を活用して、膨大な数の化合物の効果を高速かつ自動で評価する仕組みです。
この技術により、短期間で数多くの候補の中から、有望な「ヒット化合物」を見つけ出すことが可能になりました。
この段階で見つかったヒット化合物を、さらに化学的に改良(最適化)し、より薬としてふさわしい性質を持つ「リード化合物」へと育てていきます。
ステップ2:非臨床試験(期間:3~5年)- ヒトへの投与を見据えた徹底検証
基礎研究で見出された有望な候補物質(リード化合物)が、本当に薬として使える可能性があるのかを、動物や培養細胞を用いて徹底的に検証する段階です。
この試験は、ヒトに投与する前に行われるため、「非臨床試験」と呼ばれます。
かつては「前臨床試験」とも呼ばれていましたが、近年では臨床試験と並行して追加の非臨床試験が行われることもあるため、「非臨床試験」という呼称が一般的になっています。
動物や細胞で「有効性」と「安全性」を確認
非臨床試験の目的は、大きく分けて3つあります。
- 薬効薬理試験: 候補物質が、目的とする効果(薬効)を本当に持っているかを、病気のモデル動物や細胞を使って確認します。
- 安全性試験: ヒトに投与した際に、有害な作用(毒性)が出ないかを確認します。これは非臨床試験の中でも最も重要な試験の一つです。
- 薬物動態試験: 投与された候補物質が、体の中でどのように吸収・分布・代謝・排泄されるか(薬物の体内での運命)を調べます。
これらの試験は、「GLP(Good Laboratory Practice)」という、試験の信頼性を確保するための厳格な基準に則って実施される必要があります。
安全性試験の実際:どんな毒性を調べるのか?
人の命に関わる医薬品だからこそ、安全性は徹底的に検証されます。
具体的には、以下のような多角的な毒性試験が行われます。
- 単回投与毒性試験: 候補物質を1回だけ投与し、どのような毒性が現れるかを調べます。
- 反復投与毒性試験: 一定期間、毎日繰り返し投与し、長期間使用した場合の安全性を確認します。
- 遺伝毒性試験: 遺伝子(DNA)を傷つけ、突然変異を引き起こす可能性がないかを調べます。
- がん原性試験: 長期間の投与によって、がんを誘発する可能性がないかを調べます。
- 生殖発生毒性試験: 妊娠や胎児、次世代への影響がないかを確認します。
これらの試験には、心血管系、呼吸器系、中枢神経系への影響を評価する「安全性薬理試験」も含まれており、極めて高い精度が求められます。
こうした精密なデータ測定と解析は、専門的な技術を持つ企業によって支えられています。例えば、日本バリデーションテクノロジーズ株式会社が提供するような高度な生理学的データ測定・解析システムは、医薬品の安全性を担保する上で重要な役割を担っています。
日本バリデーションテクノロジーズ株式会社のような企業の技術力が、新薬開発の根幹を支えているのです。
ライターの視点
ここで見つかる予期せぬ毒性こそが、開発中止の最大の原因の一つです。
どんなに効果が期待できても、安全性が担保されなければ決して次のステップには進めません。
また、動物実験においては、倫理的な観点から動物福祉への配慮が国際的な原則となっています。
「3Rの原則」に基づき、科学的な合理性の範囲で、可能な限り動物を使用しない代替法を用いる(Replacement)、使用する動物の数を減らす(Reduction)、動物に与える苦痛を軽減する(Refinement)ことが、法律でも定められ、強く求められています。
ステップ3:臨床試験(治験)(期間:3~7年)- 「薬」になるための最終関門
非臨床試験で有効性と安全性が確認された候補物質は、いよいよヒトを対象とした試験へと進みます。
これが「臨床試験」です。
特に、新しい薬を国(厚生労働省)から「医薬品」として承認してもらうために行う臨床試験のことを、「治験」と呼びます。
治験は、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」や「GCP(Good Clinical Practice)」という国際的なルールに則り、参加する方の人権と安全を最優先しながら、科学的に適正に実施されます。
治験は、目的や対象に応じて、通常3つの段階(相)に分けて進められます。
第Ⅰ相(フェーズ1):少数の健康な人で安全性を確認
まず、ごく少数の健康な成人の方に協力いただき、候補物質(この段階では「治験薬」と呼びます)を少量から慎重に投与します。
主な目的は、ヒトにおける安全性の確認です。
副作用が出ないか、また、体内でどのように吸収され、排泄されるか(薬物動態)といったデータを収集します。
第Ⅱ相(フェーズ2):少数の患者で有効性と用法・用量を探る
第Ⅰ相試験で安全性が確認されると、次に少数の患者さんに協力いただき、治験薬を投与します。
この段階の主な目的は、有効性の確認と、最も効果的で安全な投与量や投与方法(用法・用量)を見つけ出すことです。
プラセボ(有効成分の入っていない偽薬)を用いて、治験薬の真の効果を客観的に評価することもあります。
第Ⅲ相(フェーズ3):多数の患者で有効性を最終検証
第Ⅱ相試験で有効性と安全な用法・用量の見当がついたら、最終段階として、多くの患者さんに参加いただき、大規模な試験を行います。
この段階の目的は、既存の標準的な治療薬やプラセボと比較して、治験薬の有効性と安全性を統計学的に明確に証明することです。
ライターの視点
この第Ⅲ相試験は、最も多くの時間と費用がかかるフェーズです。
ここで、既存の薬を上回る明確な有効性を示せなければ、それまでの10年近い努力が水の泡となる、非常に厳しい関門です。
多くの候補がここで脱落していきます。
しかし、この厳しい関門を乗り越えられたものだけが、次の承認申請へと進むことができるのです。
ステップ4:承認申請と審査(期間:1~2年)- 国から「薬」として認められるまで
長く厳しい臨床試験を乗り越え、有効性と安全性が証明された治験薬は、いよいよ国に「医薬品」として認めてもらうための最終ステップに進みます。
膨大なデータをまとめ、国に申請
製薬会社は、基礎研究から第Ⅲ相試験までに得られたすべてのデータをまとめ、厚生労働省に「医薬品製造販売承認申請」を行います。
申請資料は、品質、有効性、安全性に関する数万ページにも及ぶ膨大なものになります。
PMDAによる厳格な審査
申請された資料は、独立行政法人 医薬品医療機器総合機構(PMDA)という専門機関によって、科学的な見地から厳格な審査を受けます。
PMDAの専門家たちが、提出されたデータに間違いがないか、薬の有効性が本当に示されているか、安全性に問題はないかなどを、多角的に徹底して評価します。
薬事・食品衛生審議会を経て、ついに承認へ
PMDAでの審査が終わると、その結果は外部の専門家で構成される「薬事・食品衛生審議会」でさらに審議されます。
ここでの審議を経て、医薬品として承認することが妥当であると判断されると、ようやく厚生労働大臣によって正式に承認されます。
ステップ5:製造販売と市販後調査 – 「育薬」という新たなスタート
国の承認を得て、新薬はついに医療現場へと届けられます。
しかし、これで終わりではありません。
薬の開発は、患者さんに使われ始めてからも続いていくのです。
薬価収載と製造販売の開始
承認された薬は、中央社会保険医療協議会(中医協)で審議され、公的医療保険で使える薬の価格(薬価)が決められます。
薬価が決定されると(薬価収載)、ようやく製薬会社は薬を製造・販売できるようになり、医師を通じて患者さんの元へ届けられます。
市販後調査(第Ⅳ相試験)と育薬
治験では、限られた条件の患者さんしか参加できません。
しかし、市販後は、年齢、性別、合併症の有無など、様々な背景を持つ、より多くの患者さんに使われることになります。
そのため、販売開始後も、有効性や安全性に関する情報を継続的に収集・評価し、まれな副作用が起きていないかなどを監視する義務があります。
これを「市販後調査(ファーマコビジランス)」と呼びます。
ライターの視点
薬は発売されて終わりではありません。
より多くの患者さんに使われる中で得られる新たな情報をもとに、より安全で効果的な使い方を追求していく。
私たちはこれを「育薬」と呼んでいます。
薬を育てるという視点も、製薬会社の重要な使命なのです。
よくある質問(FAQ)- 構造化データ対応
Q: 新薬開発の成功確率は本当にそんなに低いのですか?
A: はい、薬の候補物質が研究開始から承認に至る確率は、約2万分の1から3万分の1と言われています。 特に、ヒトでの効果や安全性を確認する臨床試験の段階で、期待された効果がなかったり、予期せぬ副作用が見つかったりして開発が中止となるケースが多く、新薬開発は非常にリスクの高い事業です。
Q: 新薬開発にはなぜそんなに長い時間と費用がかかるのですか?
A: 人の命に関わる医薬品には、極めて高い有効性と安全性が求められるためです。科学的な発見から始まり、動物やヒトでの試験を段階的に、かつ慎重に進める必要があります。 特に数千人規模で行われることもある第Ⅲ相臨床試験には多くの時間と費用を要するため、全体で10年以上、数百億円から時には数千億円以上の開発費がかかるのが一般的です。
Q: 「治験」と「臨床試験」の違いは何ですか?
A: 「臨床試験」は人を対象に行う医学研究全般を指します。 その中で、新しい薬や医療機器を国(厚生労働省)から「医薬品」として承認してもらうために行う試験を、特に「治験」と呼びます。 治験は「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」などの厳格なルールに基づいて実施されます。
Q: AI(人工知能)は新薬開発にどう活用されているのですか?
A: AIは、膨大な論文や化合物データから薬の候補を効率的に探し出したり、臨床試験の成功確率を予測したりするなど、開発プロセスの様々な段階で活用が進んでいます。 これにより、開発期間の短縮やコスト削減、成功確率の向上が期待されており、創薬のあり方を大きく変える可能性を秘めています。 2025年現在も、AI創薬の技術は急速に進化しています。
Q: 製薬会社の研究開発職に就くにはどうすれば良いですか?
A: 多くの場合、大学の薬学部、理学部、農学部、工学部などで化学や生物学、生命科学などを専攻し、修士課程や博士課程を修了していることが求められます。 高い専門性に加え、最新の論文を読み解くための英語力も必須です。
まとめ
新薬開発は、一つの病気に苦しむ患者さんを救いたいという研究者の情熱から始まる、長く険しい道のりです。
基礎研究での無数の試行錯誤、動物で安全性を確かめる非臨床試験、そして患者さんの協力のもとで行われる臨床試験という厳しい関門を乗り越え、国による厳格な審査を経て、ようやく一つの「薬」が誕生します。
この記事を通して、普段何気なく使っている薬の裏側にある物語を感じていただけたなら幸いです。
そしてそれは、薬を正しく使うことの大切さにも繋がっていくはずです。